常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
A.H2A在水中的电离方程式是:H2A===H++HA-、HA-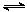 H++A2-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA |
| B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1 NA |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
下列化学用语或模型表示正确的是
| A.H2O2分子结构式:H一O一O一H | B.氮气的电子式:N 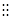 N N |
C.Mg2+结构示意图: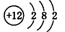 |
D.C2 H4分子比例模型: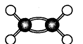 |
在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。①置换反应②化合反应③分解反应④取代反应⑤加成反应⑥消去反应⑦加聚反应 ,以上反应类型能体现这一原子最经济原则的是()
| A.①②⑤ | B.②⑤⑦ | C.只有⑦ | D.只有② |
如下图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是()
| A.蓝色石蕊试纸先变红后褪色 |
| B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性 |
| C.品红试纸褪色,证明了SO2的漂白性 |
| D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性 |
根据下列实验现象,所得结论不正确的是( )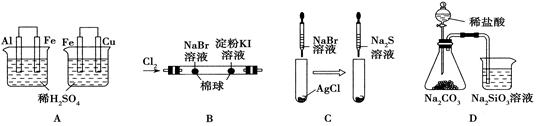
| 实验 |
实验现象 |
结论 |
| A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
左侧棉花变橙色,右侧棉花变蓝色 |
氧化性:Cl2>Br2;Cl2>I2 |
| C |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl>AgBr>Ag2S |
| D |
锥形瓶中有气体产生,烧杯中液体有浑浊现象 |
非金属性:Cl>C>Si |