25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-盐酸 与b mol·L-1氨水等体积混合,若恰好完全反应,下列结论中不正确的是
A.混合液中:c(H+ ) ≤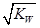 |
| B.混合液中:c(NH3·H2O)+c(NH4+)=0.5a mol·L-1 |
| C.a = b |
| D.混合液中:c(H+)+c(NH4+)= c(OH-)+c(Cl-) |
“纳米材料”是粒子直径为l~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质①是溶液②是胶体③能产生丁达尔效应④能透过滤纸⑤不能透过滤纸⑥静置后,会析出黑色沉淀
| A.①④⑥ | B.②③④ | C.②③⑤ | D.①③④⑥ |
下列溶液中不能存放在带玻璃塞的试剂瓶中的是
①氢氟酸 ② NaCl ③ KNO3 ④ Na2SiO3 ⑤ CuSO4 ⑥ NaOH ⑦ Na2CO3 ⑧ NaHSO4
| A.①④⑥⑦ | B.①③⑤⑧ | C.②③④⑦ | D.①④⑥⑧ |
下列表述正确的是
①金刚砂硬度很大,可用作砂纸、砂轮的磨料,主要成分是三氧化二铝②玛瑙的主要成分是硅酸盐③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料④钢化玻璃和普通玻璃成分不同⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能⑥高温结构陶瓷比金属材料具有许多优点,如不怕氧化、密度小等优点⑦黏土是制陶瓷、玻璃、水泥都使用的原料
| A.①②③ | B.①②⑦ | C.③④⑤ | D.③⑤⑥ |
碳素钢的分类的依据是
| A.硬度 | B.含碳量 | C.用途 | D.机械性能 |
下列有关实验操作或实验原理正确的是
| A.提取溴水中的溴,可用加入乙醇萃取的方法 |
| B.用蒸发溶剂的方法将10%的氯化铁溶液变为20%的氯化铁溶液 |
| C.用上图①的装置可以收集一瓶干燥的氨气 |
| D.用上图②的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |