在150℃时,(NH4)2CO3分解的方程式为:(NH4)2CO3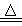 2NH3↑+H2O↑+CO2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的
2NH3↑+H2O↑+CO2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的
| A.96倍 | B.48倍 | C.12倍 | D.10倍 |
进行电解水的实验时,为增强水的导电性,需向水中加入一定量的电解质。下列物质中可以加入的是()
| A.AgNO3 | B.NaCl | C.H2SO4 | D.NaOH |
如下图,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板有无色无臭的气体放出,符合条件的是()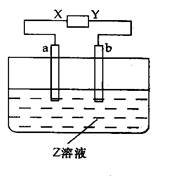
| a极板 |
b极板 |
x极板 |
溶质 |
|
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
下列有关电解池说法不正确的是( )
| A.电解池是将电能转化为化学能的装置 |
| B.与电源正极相连的是电解池的阴极 |
| C.与电源负极相连的是电解池的阴极 |
| D.在电解池中阳极发生氧化反应 |
.在25℃时,将两个铜电极插入一定质量的硫酸钠的饱和溶液中进行电解。通电一段时间后,阴极是逸出a mol气体,同时有Wg Na2SO4·10H2O晶体析出。若温度不变,剩余溶液中溶质的质量分数为();若用铂电极电解硫酸钠的饱和溶液,则剩余溶液中溶质的质量分数为()
A.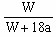 ×100% ×100% |
B. ×100% ×100% |
C.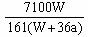 ×100% ×100% |
D.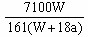 ×100% ×100% |
将质量分数为0.052(5.2%)的NaOH溶液1L(密度为1.06g/cm3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液应符合的关系是()
| NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
| A |
0.062(6.2%) |
19 |
152 |
| B |
0.062(6.2%) |
152 |
19 |
| C |
0.042(4.2%) |
1.2 |
9.4 |
| D |
0.042(4.2%) |
9.4 |
1.2 |