有关下列图象的说法正确的是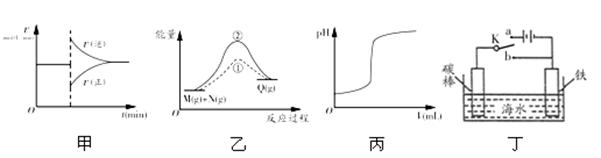
| A.图甲中的曲线可以表示某化学平衡体系改变温度后反应速率随时间的变化 |
| B.图乙中①、②曲线分别表示反应M(g)+N(g)→Q(g),ΔH>0使用和未使用催化剂时,反应过程中的能量变化 |
| C.图丙中的曲线可表示向一定量的氢氧化钠溶液中滴加一定浓度盐酸时的pH变化 |
| D.图丁中开关K置于a或b处均可减缓铁的腐蚀 |
关于有机物的以下说法中,不正确的是()
A.油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物
B. 油酸既能够使Br2的四氯化碳溶液褪色,也可使酸性KMnO4溶液褪色
C. 蔗糖、麦芽糖的化学式都可表示为C12H22O11,二者互为同分异构体
D. 向鸡蛋白溶液中加入饱和硫酸铵溶液析出白色沉淀,不属于化学变化
某烷烃有两种同分异构体,含相同数目碳原子的烯烃的同分异构体有几种(含顺反异构体)
| A.2种 | B.3种 | C.4种 | D.5种 |
下列有关氟氯代烷的说法中,不正确的是:
| A.氟氯代烷是一类含氟和氯的卤代烃 |
| B.氟氯代烷化学性质稳定,有毒 |
| C.氟氯代烷大多无色、无臭、无毒 |
| D.在平流层中,氟氯代烷在紫外线照射下,分解产生的氯原子可引发损耗臭氧的循环反应 |
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是()
| A.人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| B.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 |
| C.棉、麻、丝、毛燃烧后都只生成CO2和H2O |
| D.远距离运输水果时,为防止水果早熟,可以将水果浸泡在福尔马林溶液中 |
需加入适当的氧化剂才能实现的反应是()
A PCl5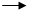 PCl3 B. MnO2
PCl3 B. MnO2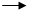 Mn2+
Mn2+
C.SO2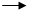 SO32- D. Fe
SO32- D. Fe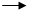 Fe3O4
Fe3O4