为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去)。请回答下列问题:
(1)仪器A的名称_________,其作用是___________。
(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是____________________________。
(3)实验记录如下(请补全空白):
| 步骤 |
实验操作 |
实验现象 |
实验结论 |
| Ⅰ |
打开活塞a,逐滴加入H2SO3溶液至过量 |
________________ |
__________________________ |
| Ⅱ |
向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 |
刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 |
__________________________ |
(4)步骤Ⅱ中,开始时颜色无明显变化的原因是(写出一条)_______________________,
步骤Ⅰ中反应的离子方程式_________________________________________________,
步骤Ⅱ中主要反应的离子方程式_____________________________________________。
为了测定一种气态烃A的分子式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。学生甲、乙设计了两个方案,均认为根据自己的方案能求出A的实验式。他们测得的有关数据如下(箭头表示气流的方向,实验前系统内的空气已排尽):
甲:燃烧产物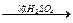 浓H2SO4增重2.52 g
浓H2SO4增重2.52 g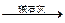 增重1.32 g
增重1.32 g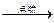 生成CO2 1.76 g
生成CO2 1.76 g
乙:燃烧产物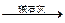 增重5.60 g
增重5.60 g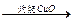 增重0.64 g
增重0.64 g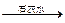 增重4 g
增重4 g
试完成下列问题:
(1)根据两方案,你认为能否求出A的实验式?
(2)请根据你选择的方案,通过计算求出A的实验式。
(3)若要确定A的分子式,是否需要测定其他数据?说明原因。
已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如上图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
| (石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为_______________g,假设广口瓶里生成一种正盐,其质量为_______________ g。
(2)生成的水中氢元素的质量为_______________ g。
(3)生成的二氧化碳中碳元素的质量为_______________ g。
(4)该燃料中碳元素与氢元素的质量比为_______________。
(5)已知这种燃料的每个分子中只能含有一个氧原子,则该燃料的分子式为______________,结构简式为_______________。
已知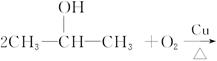
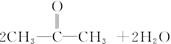
CH22CH3CH2OH+O2 2CH3CH2CHO+2H2O
2CH3CH2CHO+2H2O
C3H7X+NaOH C3H7OH+NaX
C3H7OH+NaX
试参考以上反应及有关物质的性质,用实验确定某卤代烃C3H7X分子中X的位置和种类(X可能是Cl、Br、I三种原子中的一种)。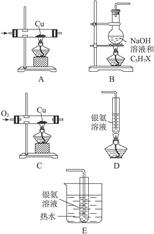
图6-14
(1)试从图6-14中选出适当的几种实验装置并连成一整套,以达到上述实验目的(用编号回答并用→连接)___________。
(2)反应完毕后,若盛有银氨溶液的试管中有银镜产生,则C3H7X的结构简式为___________;再取少量B烧瓶中的液体,冷却并用稀硝酸酸化后,再滴入___________,若产生淡黄色沉淀,则X为___________原子。
如下图所示为实验室制取少量溴苯的装置,完成下列问题: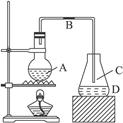
(1)烧瓶A中装的物质为____________________________________,发生反应的化学方程
式为________________________________。
(2)导管B的主要作用是______________________________________________。
(3)导管C处附近会出现白雾,其原因是
____________________________________________。
(4)反应后,向锥形瓶中滴加AgNO3溶液时,观察到的现象是_____________________,相应的离子方程式为______________________________________________。
(5)反应后,将烧瓶A中的液体倒入盛有冷水的烧杯中,烧杯底部有___________色的油状液体,带颜色的原因是________________________________,可用__________________的方法将颜色除去。
(8分)已知在烯烃R—2CH==1CH2与HBr加成反应中,Br原子参与成键的方式有两种可能:①Br原子在1C上成键;②Br原子在2C上成键。化学兴趣小组拟用0.224 L丙烯(标准状态)与足量HBr进行加成反应,希望通过定量实验的方法探究其加成方式,实验步骤如下:
(一)丙烯与HBr在适当条件下加成得到卤代烃;
(二)卤代烃在NaOH水溶液中加热;
(三)提纯得到混合醇;
(四)将混合醇蒸气通过足量的灼热铜网;
(五)导出产物,通入足量的银氨溶液中,进行银镜反应实验,完全反应后最终得到W克银。
完成下列问题:
(1)步骤(三)中提纯混合醇的简单物理方法是:将含混合醇的混合物进行__________。
(2)实验中如何测量生成银的质量?
(3)写出步骤(四)中的任意一个化学反应方程式。(只写一个)
(4)小组成员预期可能实验结果及结论?(提示:结论应具有普遍性,参考形式如“烯烃与HBr加成的方式为①/②”)