I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42-
4H++2Fe2++4SO42-
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是 。
(3)观察上述反应,硫元素最终转化为 从煤炭中分离出来。
II、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
8CuFeS2 + 21O2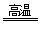 8Cu + 4FeO + 2Fe2O3 + 16SO2
8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是 。
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下: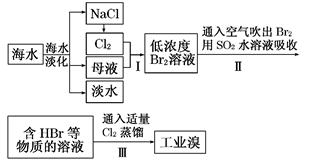
(1)请列举海水淡化的两种方法:________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为____________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
________________________________________________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_________________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图: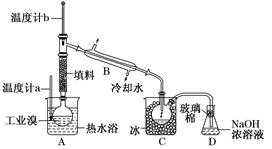
请你参与分析讨论:
①图中仪器B的名称________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是____________________________________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件________________________________________________________________________。
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下: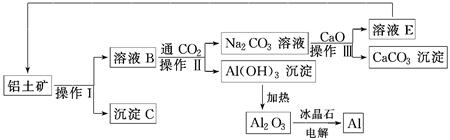
请回答下列问题。
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________________________________。
(2)写出由溶液B生成Al(OH)3的离子方程式:_________________________________________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为______________________________________________________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
某自来水厂利用河水处理成自来水的工艺流程示意图如下图所示: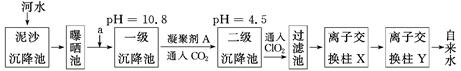
提供的试剂:饱和Na2CO3溶液、NaOH溶液、生石灰、CCl4、BaCl2溶液、KOH溶液
(1)为除去水中含有的Ca2+、Mg2+、HCO3-、Cl-、SO42-,试剂a代表两种化学物质,主要是除去水中SO42-、Mg2+和HCO3-,这两种试剂是________和________(只填化学式)。
(2)凝聚剂A常用FeSO4·7H2O,最终生成红褐色胶体沉淀,该胶状沉淀的化学式为________,可以除去其中的悬浮固体颗粒,该过程是________(填序号)。
A.只有物理变化,无化学变化
B.只有化学变化,无物理变化
C.既有化学变化,又有物理变化
(3)通入CO2的目的是__________和__________。
(4)传统的氧化剂是Cl2,现代工艺用ClO2取代Cl2,通入ClO2的作用是________________________;优点是________________________________。
(5)离子交换柱X、Y中有一种是H+型交换柱,另一种是OH-型离子交换柱,目的是除去水中残留的杂质离子,则X应是哪种交换柱?________(填“H+型”或“OH-型”);如果两个交换柱位置颠倒会产生什么后果?_______________________________________
________________________________________________________________________。
化学在材料的发展过程中起着很重要的作用,2012年度国家最高科学技术奖授予郑哲敏院士、王小谟院士,两人均在材料方面作出了巨大贡献,为国家创造出较大的经济效益。
(1)石灰石、生石灰和熟石灰均是重要的化工原料,下列工业生产中,不可能用到上述原料的是________(填序号)。
①炼铁;②炼钢;③从海水中提取镁;④铝的冶炼;⑤制水泥;⑥制玻璃;⑦制漂白粉;⑧烧制陶瓷
(2)神州八号与天宫一号的成功对接与分离,标志着我国航天工业发展进入了新阶段。下列选项中的描述与化学研究领域无关的是________。
| A.燃料燃烧为神州八号升空提供动力 |
| B.与地面指挥中心联系的无线电通讯 |
| C.宇航服使用的合成纤维等新材料 |
| D.太空舱中利用NiFeO4处理呼出的废气 |
(3)玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,它具有强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等优良性能,其中基体是__________,增强体是________。
(4)橄榄石型LiFePO4是一种锂离子电池正极材料,其中Fe元素显+2价。常向LiFePO4中加入少量活性炭黑,其作用除了可以改善LiFePO4的导电性能外,还能____________________。
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。