有某种含有少量FeCl2杂质的FeCl3样品。现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2—3g范围内):
②向样品中加入10mL 6 moL·L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重。
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是 ;
(2)加入氯水后,反应的离子方程式为 ;
(3)加入过量氨水生成沉淀的离子方程式为 ;
(4)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是 。
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
下图表示的反应关系中,部分产物被略去,已知2mol白色固体粉末X受热分解,恢复到室温生成A(白色固体)、B、C各1mol , X、E、G的焰色反应均为黄色。回答下列问题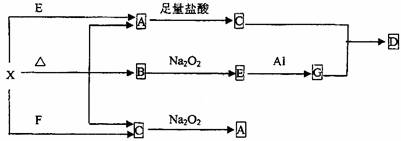
(1)写出下列物质的化学式:X,G,D
(2)写出G与C反应生成D的离子方程式____________________________
(3)写出X+E→A的离子方程式___________________________________
(4)写出C与Na2O2反应的化学方程式_________________________________
若有0.2mol Na2O2参加反应,则转移的电子数为__________________
将一小快金属钠投入到盛放FeCl2溶液的烧杯中,观察到的现象是__________________有关的离子方程式是____________________。
向橙色的溴水中通入SO2气体,观察到的现象是____________。有关的离子方程式为___________________________
在盛有淀粉碘化钾酸性溶液的试管中,滴入少量的次氯酸钠溶液后,溶液呈蓝色,说明溶液中生成了________________单质,有关的离子方程式为__________________。
磷酸(H3PO4)在水中可分三步电离,能够以H3PO4、H2PO- 4、HPO2- 4、PO3- 4等四种粒子形式存在,当溶液的pH发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分布分数)也可能发生变化。图1是某浓度H3PO4溶液中各种粒子的物质的量分数δ随pH的变化曲线。用NaOH标准溶液滴定该H3PO4溶液,绘得滴定曲线如图2。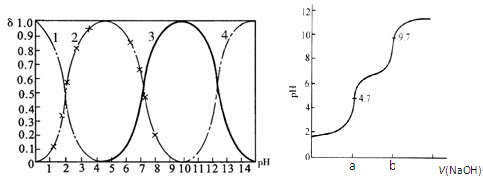
图1 H3PO4粒子分部分数与pH关系图2 H3PO4滴定曲线(部分)
(注:图中曲线1表示H3PO4、曲线2表示H2PO- 4、曲线3表示HPO2- 4、曲线4表示PO3- 4)
(1)H3PO4第一步电离的电离常数K1的表达式为_______,K1的数值最接近(填字母)______。
| A.10-2.1 | B.10-4.7 | C.10-7 | D.10-9.7 |
(2)用NaOH滴定H3PO4,写出反应从a点到b点的离子方程式____________________,当滴定至pH=7时,溶液主要存在的阴离子(OH-除外)有_______________。
(3)在Na3PO4溶液中,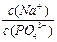 ____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
(4)磷酸钙、磷酸一氢钙和磷酸二氢钙是三种重要的磷酸盐,在食品、化肥等方面应用广泛。其20℃时溶解度数据如下表:
| 名称 |
化学式 |
20℃时溶解度(g) |
| 磷酸钙 |
Ca3(PO4)2 |
2×10-3 |
| 磷酸一氢钙 |
CaHPO4 |
4.3×10-3 |
| 磷酸二氢钙 |
Ca(H2PO4)2 |
1.8 |
磷酸钙在水中溶解度很小,但易溶于稀盐酸。结合平衡移动原理分析其原因
_________________________________________________________________。