下列说法中正确的是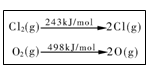
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的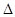 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g) 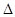 H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 molO2 反应放出115.6 kJ热量,键能如表所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ |
下列关于σ键和π键的理解不正确的是
| A.σ键一般能单独形成,而π键一般不能单独形成 |
| B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C.CH3-CH3.CH2=CH2.CH≡CH中σ键都是C-C键,所以键能都相同 |
| D.碳碳双键中有一个σ键,一个π键,碳碳叁键中有一个σ键,两个π键 |
已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是
| 元素 |
I1 |
I2 |
I3 |
I4 |
| X |
500 |
4600 |
6900 |
9500 |
| Y |
580 |
1800 |
2700 |
11600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
某原子在处于基态时,外围电子排布为4d15s2,则下列说法正确的是
| A.该元素原子处于基态时,原子中共有3个未成对电子 |
| B.该元素原子的M能层共有8个电子 |
| C.该元素原子核外共有5个电子层 |
| D.该元素原子最外层有3个电子 |
电子在一个原子的下列能级的原子轨道中排布时,最后排布的是
| A.np | B. ns | C.(n-1)d | D.(n-2)f |
已知X.Y元素同周期,且电负性X>Y,下列说法正确的是
| A.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 |
| B.在同一周期中X位于Y的左面 |
| C.Y的气态氢化物的稳定性大于X的气态氢化物的稳定性 |
| D.X与Y形成的化合物中,X显负价,Y显正价 |