利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。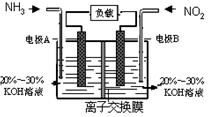
下列说法不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电极A极反应式为:2NH3-6e-=N2+6H+ |
| D.当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol |
下列说法不正确的是()
| A.乙醇做燃料易燃烧,污染小,但不可再生 |
| B.选择燃料需要考虑燃料热值的大小 |
| C.若反应物总能量大于生成物总能量则反应为放热反应 |
| D.将煤制成水煤气提高燃料的利用率 |
下列关于元素周期律和元素周期表的说法中正确的是( )
| A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 |
| B.元素的性质随着原子序数的增加而呈周期性变化 |
| C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
| D.最外层电子数为8的粒子是稀有气体元素的原子 |
天然维生素P(结构如图)存在于槐树花蕾中,关于维生素P的叙述错误的是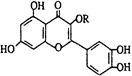
| A.可以和溴水反应 | B.1mol维生素P最多可以和4molNaOH反应 |
| C.分子中有三个苯环 | D.可溶于有机溶剂 |
下列关于乙炔的说法不正确的是
| A.燃烧时有浓厚的黑烟 |
| B.可通过酸性高锰酸钾溶液来区别烯烃和炔烃 |
| C.为了减缓电石和水的反应速率用饱和食盐水来代替 |
| D.乙炔的收集方法可用排水法 |
对下列有关实验的描述正确的是
| A.配制银氨溶液时将硝酸银溶液逐滴滴入氨水中 |
| B.乙醇中混有乙酸,加蒸馏水,然后分液 |
| C.苯中混有苯酚,加浓溴水,然后分液 |
| D.溴苯中混有溴,加NaOH溶液,然后分液 |