下列说法不正确的是
| A.可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| B.雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
| C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D.据测定,许多反应的温度每升高10K,其反应速率增加2~4倍。在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率 |
已知下列反应的能量变化示意图如下,有关说法正确的是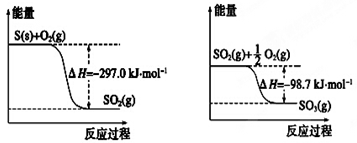
| A.1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ |
| B.在相同条件下,SO2(g)比SO3(g)稳定 |
C.S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+ O2(g) O2(g) SO3(g)ΔH=+395.7kJ·mol-1 SO3(g)ΔH=+395.7kJ·mol-1 |
D.一定条件下1 mol SO2(g)和 mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ |
下列事实不能用勒夏特列原理解释的是
| A.氨水应密闭保存 |
| B.光照新制氯水,溶液中的C(H+)增大 |
| C.工业生产硫酸的过程中使用过量氧气以提高SO2的利用率 |
| D.500℃比室温更有利于氨气的合成 |
在恒容密闭容器中A(g)+3B(g) 2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
| A.容器中混合气体的平均相对分子质量增大 |
| B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.正反应速率和逆反应速率都变小,C的百分含量增加 |
| D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
高炉炼铁过程中发生的主要反应为: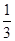 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 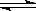
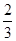 Fe(s)+CO2(g) ΔH < 0 ,欲提高CO的平衡转化率,可采取的措施是
Fe(s)+CO2(g) ΔH < 0 ,欲提高CO的平衡转化率,可采取的措施是
①增加Fe2O3的量②移出部分CO2③提高反应温度④减小容器的容积 ⑤加入合适的催化剂 ⑥降低反应温度
| A.①③ | B.②⑥ | C.②④ | D.④⑥ |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: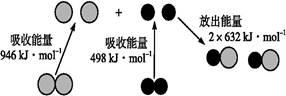
下列说法中正确的是
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |