银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阳极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为
(2)固体混合物B的组成为 ;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为: 。
(3)完成煅烧过程中一个反应的化学方程式: CuO + Al2O3 CuAlO2 + ↑
CuAlO2 + ↑
煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为 。这个反应中会有白烟产生,该白烟为 。
(4)若银铜合金中铜的质量分数为64%,理论上6.0kg废料中的铜可完全转化为 molCuAlO2,至少需要1.0 mol·L-1的Al2(SO4) 3溶液 L。
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。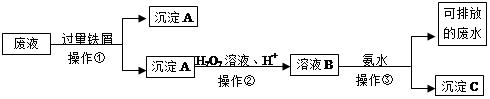
(1)操作①的名称是。
(2)沉淀A中含有的金属单质有。
(3)操作②中在酸性下发生反应的离子方程式。
(4)检验溶液B中含有的金属阳离子常用的试剂是。
(5)操作③中发生反应的离子方程式为。
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:_________。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。
化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中镁的总储量约为1.8×1015 t,海水里镁的存在形式主要是。(填“游离态”或“化合态”)
②下列物质不经过化学变化就能从海水中获得的是。(填字母)
A.单质钠 B.单质钾 C.氯化钠
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①工业上制造光导纤维的基本原料是。
②下列物质中,不能用来制造耐火材料的是。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
(3)保持洁净安全的生存环境已成为全人类的共识。
①pH<的雨水称为酸雨。
②下列物质中,会破坏臭氧层的是。(填字母)
A.氮气 B.一氧化碳 C.氟氯烃
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):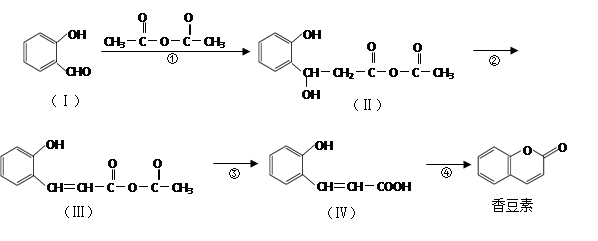
(1)Ⅰ的分子式为;
(2)反应②的反应类型是,反应④的反应类型是。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为(任写一种)。
(5)一定条件下,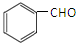 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为。
A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B的相对分子质量之差为。
(2)1个B分子中应该有个氧原子。
(3)A中所含的官能团有:。
(4)B可能的结构简式是。
(5)1molB物质分别与足量的碳酸氢钠溶液、氢氧化钠溶液反应理论上消耗二者的物质的量之比是。