某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量)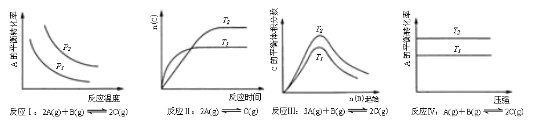
根据以上规律判断,上列结论正确的是
| A.反应Ⅰ:△H>0,P2>P1 |
| B.反应Ⅱ:△H<0,T1>T2 |
| C.反应Ⅳ:△H<0,T2>T1 |
| D.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 |
能说明醋酸是弱电解质的事实是
①用浓硫酸和醋酸钠固体共热可以制得醋酸,
②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,
④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
对于金属冶炼的工业方法,下列有关说法中正确的是
| A.可用电解饱和的MgCl2溶液的方法获得金属镁 |
| B.电解CuSO4溶液精炼金属铜时,用铁做阳极 |
| C.电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作助熔剂 |
| D.工业上常采用活泼金属还原法冶炼金属银 |
物质的量浓度相同的下列溶液中,按pH由小到大顺序排列的是
| A.Na2CO3、NaHCO3、NaCl、HCl |
| B.Na2CO3、NaHCO3、HCl、NaCl |
| C.(NH4)2SO4、NH4Cl、NaNO3、Na2CO3 |
| D.NH4Cl、(NH4)2SO4、Na2CO3、NaNO3 |
下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O H3O++CO32- H3O++CO32- |
B.PO43-+3H2O H3PO4+3OH- H3PO4+3OH- |
C.NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
D.H2O+H2O H3O++OH- H3O++OH- |
5.6g铁粉投入到足量的100mL2mol/L的稀硫酸中,2min时铁粉刚好溶解,下列表示这个反应的速率正确的是
| A.v(Fe)=0.5mol/(L•min) | B.v(H2SO4)=1mol/(L•min) |
| C.v(H2)=0.5mol/(L•min) | D.v(FeSO4)=0.5mol/(L•min) |