某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是
2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是
A、均减半 B、均加倍 C、均增加1 mol D、均减少1 mol
下表中的实验操作能达至实验目的或得出相应结论的是()
| 选项 |
实验操作 |
实验目的或结论 |
| A |
向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加0.01mol·L-1NaCl溶液,至不再有沉淀生成,再向其中滴加 0.01mol·L-1Nal溶液,产生黄色沉淀。 |
常温下,Ksp(AgCl)>Ksp(Agl) |
| B |
C2H5Br与NaOH溶液混合充分振荡,再加入AgNO3溶液 |
检验C2H5Br中的溴元素 |
| C |
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 |
说明溶液中一定含有Fe2+ |
| D |
将少量某物质滴加到新制的氢氧化铜悬浊液中,加热后有红色沉淀生成 |
说明该物质一定是醛 |
下列实验装置和操作正确的是()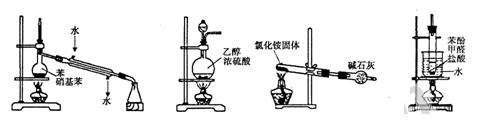
| A.分离苯和硝基苯 | B.制取乙烯 |
| C.制取氨气 | D.制备酚醛树脂 |
常温下,下列各组离子在指定溶液中能大量共存的是()
| A.无色透明的溶液中:MnO4、SO42-、K+、Fe2+ |
| B.pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ |
| C.c(SO32-)=0.5 mol·L-1的溶液中:ClO-、Na+、Cl-、CO32- |
| D.水电离产生的c(H+)=1×10-14mol·L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
设nA为阿伏加德罗常数的值,下列叙述正确的是()
| A.常温常压下,16g14CH4所含中子数目为8nA |
| B.标准状况下,22.4 LCCl4所含分子数目为nA |
| C.1 L 0.5 mol·L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5n |
| D.6.2g白磷(分子式为P4,分子结构如右图所示)所含P-键数目为0.3nA |

下列有关说法错误的是()
| A.利用铝热反应可以冶炼熔点较高的金属 |
| B.用作“钡餐”的物质主要成分是硫酸钡 |
| C.常温下,可以用铁制容器来盛装冷的浓硫酸 |
| D.人造刚玉熔点很高,可用作高级耐火材料,其主要成分是二氧化硅 |