在恒容密闭容器中进行的反应:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,
C2H5OH(g)+3H2O(g) △H 。在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见右图中曲线①②③),测得CO2的平衡转化率与温度关系如下图所示,
下列有关说法正确的是
| A.该反应:△H >0 |
| B.氢碳比:①<②<③ |
| C.其它条件不变的情况下,缩小容器的体积可提高CO2的转化率 |
| D.若起始CO2浓度为2mol·L-1、H2为4mol·L-1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.7 |
第3周期元素的原子,其最外层p能级上仅有一个未成对电子,它最高价氧化物对应的水化物的酸根离子可能是
| A.RO2- | B.RO3- | C.RO42- | D.RO4- |
下列数据是对应物质的熔点,结合所学知识,有关的判断错误的是
| Na2O |
Na |
AlF3 |
AlCl3 |
Al2O3 |
BCl3 |
CO2 |
SiO2 |
| 920 ℃ |
97.8 ℃ |
1291 ℃ |
190 ℃ |
2073 ℃ |
-107 ℃ |
-57 ℃ |
1 723 ℃ |
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物分子中各原子都形成8电子稳定结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
下列轨道表示式能表示氮原子的最低能量状态的是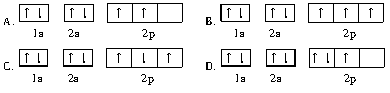
现有如下各种说法,正确的是
①在水中氢、氧原子间均以化学键相结合
②金属元素的原子和非金属元素的原子化合均形成离子键
③离子键是阴、阳离子的相互吸引力
④根据电离方程式HCl===H++Cl-,判断HCl分子中存在离子键
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子中共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程
| A.①②⑤正确 | B.都不正确 |
| C.④正确,其他不正确 | D.仅①不正确 |
在金属晶体中,根据影响金属键的因素判断下列各组金属熔沸点高低顺序,其中正确的是
| A.Mg>Al>Ca | B.Al>Na>Li |
| C.Al>Mg>Ca | D.Mg>Ba>Al |