已知某溶液中c(Na+)=0.2 mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4 mol/L,如果溶液中还有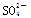 ,那么c(SO42-)应为
,那么c(SO42-)应为
| A.0.1 mol/L | B.0.3 mol/L | C.0.15 mol/L | D.0.5 mol/L |
下列对图象描述正确的是
| A.图①表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系 |
| B.图②表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系 |
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应过程中,SO2和O2反应速率大小关系 2SO3(g)反应过程中,SO2和O2反应速率大小关系 |
| D.图④表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系 |
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
| A.在有机化工中,氯气是合成塑料、橡胶、农药和人造纤维的重要原料 |
| B.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的 |
| C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D.油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量 |
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.元素X的简单气态氢化物的热稳定性比W的弱 |
| B.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
| C.原子半径的大小顺序:ry > rz > rw > rx |
| D.化合物YX、ZX2、WX3中化学键类型相同 |
某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为b mol。下列叙述,错误的是
A.溶液中c(H+) =
B.物质的量浓度c(HA) = mol·L-1
mol·L-1
C.t℃时,HA的溶解度S =
D.HA的质量分数w(HA) =
有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e- CO32-+7H2O
CO32-+7H2O
D.放电一段时间后,溶液的pH减小