现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_______(填序号,下同),水的电离程度相同的是__________。
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②___③(填“>”,“<”或“=”)
(3)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
碘化钾溶液久置于空气中,发生如下反应:
______KI+______O2+______H2O=______I2+______KOH
(1)在______上填上正确的化学计量数并用双线桥法标出电子转移的方向和数目;
(2)在该反应中,还原产物是________(填化学式);
(3)当有0.2mol电子发生转移时,生成I2的质量为________g。
二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) ΔH1=-55.7 kJ/mol
②2CH3OH(l) =CH3OCH3(g)+H2O (l)ΔH2=-23.4 kJ/mol
③CO2 (g)+H2(g) =CO(g) + H2O (l) ΔH3
④H2O (l) = H2O (g) ΔH4=+ 44.0 kJ/mol
(1)已知反应CO2 (g)+H2(g) =CO(g) + H2O (g) ΔH,中相关的化学键键能数据如下:
| 化学键 |
H-H |
C O O |
H-O |
C-H |
C=O |
| E/(kJ·mol-1) |
436 |
1076 |
465 |
413 |
745 |
由此计算ΔH=______________,则ΔH3 =________________。
(2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是_______________________。
(3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示,图中A点和B点的平衡常数比较:
KA________KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:___________________。
(4)常温常压下,向一个2.00 L的密闭恒容容器中加入等量2.00 mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150 mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)。
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5 L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 T/℃ |
活性炭 |
NO |
E |
F |
| 初始 |
3.000 |
0.10 |
0 |
0 |
| T1 |
2.960 |
0.020 |
0.040 |
0.040 |
| T2 |
2.975 |
0.050 |
0.025 |
0.025 |
(1)写出NO与活性炭反应的化学方程式 ;
(2)计算上述反应T1℃时的平衡常数K1= ;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为 ;
(4)右图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。请判断该反应△H 0(填“>”或“<”)。
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红色锈斑。请回答:
写出铁锅腐蚀时正极的电极反应式: 。
II.氯碱工业中电解饱和食盐水的原理示意图如下图所示: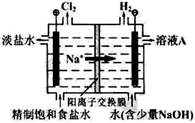
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用平衡移动移动原理解释盐酸的作用: 。
Ⅲ.(1)按右图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式: ;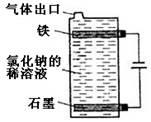
(2)将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的(3)现象是 。
有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是 ,则A的分子式是____________;
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团是 ;
(3)A分子的核磁共振氢谱有4个吸收峰,峰面积之比是1:1:1:3,则A的结构简式是________________________;
(4)请写出官能团与A相同的同分异构体的结构简式 。