【化学一有机化学基础】
I.莽草酸是有效应对H5N1型禽流感病毒的药物“达菲”的重要成分。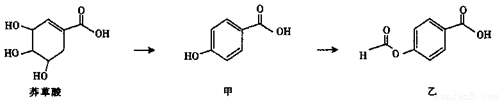
(1)莽草酸中可发生加成反应的官能团为______ (填名称)。
(2)等物质的量的莽草酸、甲、乙分别与NaOH溶液完全反应,消耗NaOH的物质的量之比为______。
(3)写出符合以下条件的莽草酸的同分异构体的结构简式____________。
(i)链状结构,含三种氢,有两个甲基。
(ii)能与NaOH溶液反应。
II.PET为聚合物,用于生产矿泉水塑料瓶。PET生产流程如下图: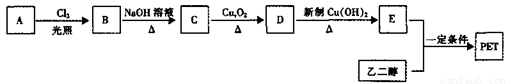
已知:A、B、C、D、E都是苯的对位二元取代物,A为烃,E与邻苯二甲酸互为同分异构体。
(4)B→C的反应类型为______。
(5)能鉴别C和D的试剂是______。
(6)E与乙二醇反应生成PET的化学方程式为____________。
某工厂甲、乙两车间,分别排放的污水中含有大量的Ag+、Ba2+、Fe3+、Na+、Cl-、 、
、 、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
(1)甲车间污水中含有的四种离子可能是___________________________。
(2)乙车间污水中含有的四种离子可能是___________________________。
分子由____________基和____________基构成的物质称为表面活性剂.根据在水溶液中电离出的表面活性微粒所带电荷的不同,表面活性剂分为____________、____________、____________和____________。
12.4 g Na2X中含有0.4 mol Na+,Na2X的摩尔质量是 g·mol ,它的相对分子质量是 ,X的相对原子质量是 ,该物质的化学式是 。
,它的相对分子质量是 ,X的相对原子质量是 ,该物质的化学式是 。
有五种物质是①6 g H2②0.5 mol CO2③1.204×10 个氯化氢分子④147 g硫酸
个氯化氢分子④147 g硫酸
⑤92 g乙醇(C2H5OH),它们的物质的量最大的是,所含分子数最多的是,含有原子个数最多的是,质量最大的是。
9.03×10 个氨分子含摩氮原子,摩氢原子,摩质子,个电子。
个氨分子含摩氮原子,摩氢原子,摩质子,个电子。