下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.在合成氨的反应中,降温或加压有利于氨的合成 |
| D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅 |
某元素构成的双原子单质分子有3种,其相对分子质量分别为158、160、162,在天然单质中,此三种单质的物质的量之比为1:1:1,由此推断的以下结论中,正确的是()
| A.此元素有三种核素 |
| B.其中质量数为79的核素占原子总数的1/3 |
| C.其中一种核素的质量数为80 |
| D.此元素的单质的平均相对分子质量为160 |
下列事实与胶体无关的是()
| A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 |
| B.将NaCl研磨成直径在1~100nm的颗粒然后分散于水中形成的分散系 |
| C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通道 |
| D.氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素),BrCl+H2O=HCl+HBrO,以下推论不正确的是( )
| A.BrCl具有和卤素单质相似的化学性质 |
| B.BrCl和M反应时,BrCl只作氧化剂 |
| C.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐 |
| D.将BrCl跟FeSO4溶液反应,溶液会变成无色 |
设NA为阿伏加德罗常数值,下列说法中正确的是()
| A.氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 |
| B.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| C.12g NaHSO4在熔融时离子总数为0.3NA |
| D.标准状况下,11.2L氦气所含的原子数为0.5NA |
下列选用的相关仪器符合实验要求的是()

| A.存放液溴 | B.量取9.50 mL水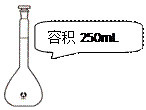  |
| C.称量8.55g氯化钠固体 | D.配制240 mL 0.1mol/L的NaCl溶液 |