同条件等体积等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
| A.仍相同 | B.醋酸大 | C.盐酸大 | D.无法判断 |
下列物质中,含有非极性键的共价化合物是()
| A.CH3CH3 | B.Na2O2 | C.NaCl | D.N2 |
关于元素周期表的说法正确的是()
| A.元素周期表有8个主族 | B.元素周期表有7个周期 |
| C.短周期是指第一、二周期 | D.第IA族的元素全部是金属元素 |
下列递变规律不正确的是()
A.Na、Mg、Al还原性依次减弱 B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大 D.P、S、Cl最高正价依次升高
对于可逆反应M + 3N  2Q 达到平衡时,下列说法正确的是()
2Q 达到平衡时,下列说法正确的是()
| A.M、N、Q三种物质的浓度一定相等 | B.M、N全部变成了Q |
| C.反应混合物各组分的浓度不再变化 | D.反应已经停止 |
下列化学用语的书写正确的是()
| A.乙酸的分子式:C2H4O2 |
| B.乙烯的结构简式 C2H4 |
C.F原子结构示意图: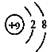 |
D.四氯化碳的电子式: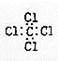 |