对于密闭容器中进行的反应:2NO2 N2O4,下列说法正确的是
N2O4,下列说法正确的是
| A.增大NO2的浓度,平衡常数增大 |
| B.增大N2O4的浓度,平衡常数增大 |
| C.增大NO2的浓度,正反应速率加快,逆反应速率减慢 |
| D.增大NO2的浓度,平衡常数不变 |
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
| A.乙炔 | B.丙炔 | C.丁炔 | D.丁二烯 |
符合下列条件的烃的一氯代物共有(不考虑立体异构)
①分子中碳元素与氢元素的质量之比为21:2;②含一个苯环;③相对分子质量小于150。
| A.2种 | B.3种 | C.4种 | D.5种 |
下列各组有机物中,只需加入溴水就能一一鉴别的是
| A.己烯、苯、四氯化碳 | B.苯、乙炔、乙烯 |
| C.己烷、苯、环己烷 | D.甲苯、乙烷、乙烯 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.15g甲基所含有的电子数是10 NA个 |
| B.1mol苯乙烯中含有的碳、碳双键数为4NA个 |
| C.标准状况下,1 L庚烷所含有的分子数为NA/22. 4 |
| D.常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
下列说法中正确的是
A.按系统命名法,有机物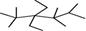 的命名为2,3,3,5,5 的命名为2,3,3,5,5 五甲基4,4二乙基己烷 五甲基4,4二乙基己烷 |
| B.已知C—C键可以绕键轴自由旋转,甲苯分子中最多有13个原子处于同一平面上 |
| C.聚乙烯能使溴水褪色 |
| D.等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |