铁在工农业生产、生活等方面都有重要的应用。
(1)正常人体内铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
则,在人体中进行Fe3+→Fe2+的转化时,Fe3+作 剂,发生 反应。
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为 。
(3)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,写出该反应的化学方程式,并标出电子转移的方向和数目 。
(4)实验室中,制取Fe(OH)3胶体的操作是 ;
该反应的离子方程式是 ;
证明胶体已经制成的方法是 。
工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O===H2SO4+2HI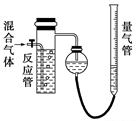
(1)混合气体进入反应管后,量气管内增加的水的体积等于________的体积(填写气体的化学式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气。则测得的SO2含量________(选填“偏高”、“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用__________代替(填写物质名称)。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1,N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量为________。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为________(选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
工业纯碱主要含有NaCl和NaHCO3杂质,为了鉴定纯碱的含量,常用酸碱滴定测定总碱度,反应产物为NaCl、CO2和H2O。当盐酸与一定工业纯碱恰好完全反应时,溶液pH 3.8~3.9(滴定时NaHCO3也被中和)。工业纯碱的总碱度测定值通常以Na2CO3%和Na2O%表示。
主要实验步骤:①准确称取工业纯碱试样2.00 g;②用适量水配制成体积一定的溶液;③准确移取一定量的所配试液,再用0.01 mol·L-1盐酸标准液滴定,测其总碱度。
请回答以下问题:
(1)称取固体工业纯碱试样时,为什么试样取尽量多些并且力求均匀?
________________________________________________________________________。
(2)在准确称取纯碱试样后,为继续进行实验,除选用烧杯、玻璃棒、酸式滴定管、碱式滴定管、锥形瓶之外。还需要的仪器用品(试剂除外)有
____________________________________________________________。
(3)在滴定操作中,应选用的指示剂是
________________________________________________________________________。
(4)假如所称取的纯碱试样中,除含有2%的NaCl外,另外的杂质中只有NaHCO3,那么NaHCO3含量的大小对该试样总碱度的测定值有何影响?
________________________________________________________________________
________________________________________________________________________。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按以下框图进行反应。又知E溶液是无色的,请回答:
(1)A是________、B是________、C是________(请填化学式)。
(2)反应①的化学方程式为:
________________________________________________________________________。
(3)反应③的化学方程式为:
________________________________________________________________________。
(4)反应④的化学方程式为:
________________________________________________________________________。
某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8000~10000 mg·L-1。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。本品须密封,置阴凉暗处保存。请完成以下填空:
(1)推测该消毒液的酸碱性:________,
原因是(用离子方程式表示)____________________________________________。
(2)该消毒液还具有的化学性质是________性和________性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是
________________________________________________________________________。
在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是( )
| A.防止氯气扩散到空气中造成污染 |
| B.便于控制加入盐酸的量 |
| C.长颈漏斗不便于添加液体 |
| D.尽量避免HCl挥发到空气中 |