(16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
| 物理量 |
|
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| |
浓度/mol·L-1 |
体积/mL |
浓度/mol·L-1 |
体积/mL |
||
| ① |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
| ② |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
|
|
|
0.010 |
4.0 |
25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n (KMnO4) ≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=______________mol·L-1·min-1。
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。其中反应速率最快的阶段是_____,原因是 。 
(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。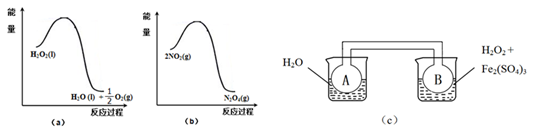
(14分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜。碱洗时常有气泡冒出,该气体的名称为。
②为将碱洗槽液中的铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的。
A.NH3 B.CO2 C.NaOHD.HNO3
③以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是。
(3)下列关于金属腐蚀的事实中,与电化学腐蚀有关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.为保护海轮的船壳,常在船壳上镶入锌块
C.在空气中,金属银的表面生成一层黑色物质
D.镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
(4)利用下图装置,可以模拟铁的电化学防护。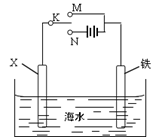
①若X为碳棒,为减缓铁的腐蚀,开关K应置于处。
②若X为锌,开关K应置于处。
思考下列问题,按要求填空:
(1)某温度下纯水中c(H+) = 2×10-7 mol/L
①此时溶液中的C(OH-) = _____。
②若温度不变,向水中滴入稀盐酸使c (H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) =_____。
(2)已知下列热化学方程式:Zn(s)+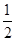 O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
Hg(l)+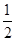 O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
由此可知反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的焓变为_____。
(3)在稀氨水中存在下述电离平衡NH3+H2O  NH3 ·H2O
NH3 ·H2O  NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?_____(填“增大”、“减小”或“不变”);平衡移动方向如何?_____(填“正向”、“逆向”或“不移动”)。
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?_____(填“增大”、“减小”或“不变”);平衡移动方向如何?_____(填“正向”、“逆向”或“不移动”)。
| 加入的物质 |
少量(NH4)2SO4固体 |
少量HNO3溶液 |
少量KOH溶液 |
| c(OH-)的变化 |
减小 |
||
| 平衡移动方向 |
逆向 |
逆向 |
(4)如图所示,装置B中两电极均为石墨电极,试回答下列问题:
①判断装置的名称:A池为________。
②锌极为______极,电极反应式为____________;
③当C2极析出224 mL气体(标准状况下),锌的质量减少__g
已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成2mol HI需要(填“放出”或“吸收”)11k J的热量。此反应中反应物的总能量(填“大于”或“小于”)生成物的总能量。物质具有的能量越(填”高”或”低”)越稳定。
根据所学知识回答下列问题,在如图所示装置中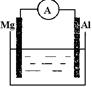 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 ,正极反应式为,负极反应式为,
该装置中的能量变化形式为。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为。D在周期表中位置 。
(2)写出E的电子式:。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:。