在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的
同温同压下,等质量的下列气体所占有的体积最大的是
| A.O2 | B.CH4 | C.CO2 | D.SO2 |
下列叙述正确的是
| A.同温同压下,相同体积的物质,其物质的量一定相等 |
| B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| C.1L一氧化碳气体一定比1L氧气的质量小 |
| D.相同条件下的一氧化氮气体和氮气,若体积相等,则质量一定相等 |
气体体积的大小与许多因素有关.当温度和压强相同时,气体体积主要取决于
| A.气体的物质的量 | B.气体分子之间的平均距离 |
| C.气体分子本身的大小 | D.气体的种类 |
下列叙述正确的是
| A.1mol H2O的质量为18g/mol |
| B.CH4的摩尔质量为16g |
| C.3.01×1023个SO2分子的质量为32g |
| D.标准状况下,1mol任何物质体积均为22.4L |
水的相对分子质量为18,则一个水分子的质量为
A.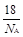 |
B.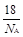 g·mol-1 g·mol-1 |
C.18NA g | D.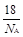 g g |