关于2mol二氧化碳的叙述中,正确的是
| A.二氧化碳的摩尔质量为44 g |
| B.质量为88g |
| C.分子数为6.02×1023 |
| D.含有4mol原子 |
利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是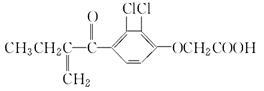
| A.利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 |
| B.利尿酸分子内处于同一平面的原子不超过10个 |
| C.1 mol利尿酸能与7 mol H2发生加成反应 |
| D.利尿酸不能与溴水反应 |
下列关于有机物因果关系的叙述中,完全正确的一组是
| 选项 |
原因 |
结论 |
| A |
乙烯和苯都能使溴水退色 |
苯分子和乙烯分子含有相同的碳碳双键 |
| B |
乙酸分子中含有羧基 |
可与NaHCO3溶液反应生成CO2 |
| C |
纤维素和淀粉的分子式均为(C6H10O5)n |
它们属于同分异构体 |
| D |
溴乙烷和乙烯在一定条件下都能与水反应 |
两个反应属于同一反应类型 |
某些芳香族化合物的分子式为C7H8O,其中与FeCl3溶液混合后能发生显色反应和不发生显色反应的种类分别是
| A.2种和1种 | B.2种和3种 | C.3种和1种 | D.3种和2种 |
下列物质中,发生消去反应生成的烯烃只有一种的是
①2丁醇②2甲基2丙醇 ③1丁醇 ④2甲基2丁醇
| A.①② | B.②③ | C.②④ | D.③④ |
下列有机化合物分子中的所有碳原子不可能处于同一平面的是
A.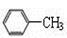 |
B.HC≡C-CH3 | C.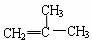 |
D.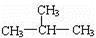 |