一定条件下,向密闭恒容容器中加入1.0mol/L X,发生反应:2X(g)⇌Y(g)+Z(g),△H<0,反应到8min时达到平衡;在14min时改变的温度,16min时建立新平衡.X的物质的量浓度变化如图所示.下列有关说法正确的是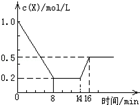
| A.0~8min用Y表示的该反应的速度为0.1mol/(L﹒min) |
| B.8min时达到平衡,该反应的平衡常数为 K=0.5 |
| C.14min时,改变的反应条件是降低了体系的温度 |
| D.16min时的正反应速率,比8min时的正反应速率大 |
可逆反应N2+3H2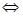 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
| A.3v正(N2)=v正(H2) | B.v正(N2)=v逆(NH3) |
| C.2v正(H2)=3v逆(NH3) | D.v正(N2)=3v逆(H2) |
在一定条件下,将A2和B2两种气体通入1 L密闭容器中,反应按下式进行:xA2(g)+yB2(g) 2C(g),两秒钟后反应速率如下:v(A2)="0.4" mol·L-1·s-1,v(B2)="1.2" mol·L-1·s-1,v(C)="0.8" mol·L-1·s-1,则该x和y的值分别为( )
2C(g),两秒钟后反应速率如下:v(A2)="0.4" mol·L-1·s-1,v(B2)="1.2" mol·L-1·s-1,v(C)="0.8" mol·L-1·s-1,则该x和y的值分别为( )
A.2和3 B.3和2 C.3和1 D.1和3
下列说法正确的是( )
| A.化学反应的实质就是分子之间的重新组合 |
| B.化学反应往往伴随着能量的改变,有的是以热能的形式出现 |
| C.化合反应一定是放热反应 |
| D.分解反应一定是吸热反应 |
根据下表给出的几种物质的溶沸点数据,判断下列说法中错误的是()
| NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
单质B |
|
| 熔点/℃ |
810 |
710 |
180 |
—68 |
2300 |
| 沸点/℃ |
1465 |
1418 |
160 |
57 |
2500 |
A、SiCl4是分子晶体; B、单质B可能是原子晶体;
C、AlCl3加热能升华; D、NaCl 比MgCl2更易熔化。
关于晶体的下列说法正确的是()
| A.在晶体中只要有阴离子就一定有阳离子 |
| B.在晶体中只要有阳离子就一定有阴离子 |
| C.原子晶体的熔点一定比金属晶体的高 |
| D.分子晶体的熔点一定比金属晶体的低 |