工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g) ⇌CH3OH(g)
(1)下图表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,写出反应的热化学方程式 ;
选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热。
(2)该反应平衡常数K的表达式为K= ,温度升高,平衡常数K (填“增大”、“不变”或“减小”);
(3)恒容条件下,下列措施中能使 增大的有 。
增大的有 。
a.升高温度 b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂.
(8分)俗话说“民以食为天”,食物是人类赖以生存的物质基础。
| 主食 |
副食 |
饮料 |
| 米饭 |
烧豆腐、红烧鱼、三层肉 |
牛奶 |
上表是小明制定的食谱,在食谱中含有的营养素主要有,,。小明制订的食谱中还缺乏的一种营养素是。
用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,该种腐蚀属,反应的电极反应式为。若用铝制饭盒盛放食盐(含水时),一段时间后,饭盒被腐蚀,这种腐蚀叫做,反应原理是(写电极反应式)。
(6分)四种短周期元素的微粒信息如下表:
| 元素代号 |
Q |
R |
X |
Z |
| 微粒信息 |
离子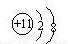 |
单质分子R2 |
离子:X3+ |
一种原子816Z |
已知Q、R、X在同一周期,R2在常温常压下为气态。完成下列填空:
(1)Q位于周期表第----周期----族。化合物Q2Z的电子式为(元素符号表示)
(2)Q、R、X的原子半径由大到小的顺序为。Q、R、X、Z中金属性最强的是(元素符号表示)
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为
(1)用惰性电极电解饱和NaCl溶液,请写出:
① 阳极的电极反应为:;
总反应离子方程式:。
② 要使电解后的溶液恢复到和原溶液一样,则应加入一定量的。
(2)用电解法精炼粗铜,电解液选用CuSO4溶液。请回答:
① 阳极的电极材料是,电极反应式是;
② 阴极电极的材料是,电极反应式是。(杂质发生的电极反应不必写出)
由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式。若1 g水蒸气转化为液态水放热2.444 kJ,则反应H2(g) + 1/2 O2(g) = H2O(l)的△H = kJ·mol-1。