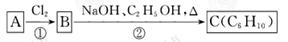中国淮北是一座煤城,煤炭要经过深加工后方可使用,主要是煤燃烧后产生大量污染气体(如SO2等)。临涣煤焦化工厂研制出了利用低品位软锰矿浆(主要成分是MnO2)吸收煤炭废渣高温焙烧产生的SO2,制备MnSO4·H2O(易溶于水,不溶于无水乙醇)的生产流程图如下:
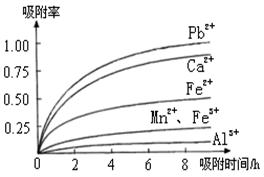
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式 。
(2)写出氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节的范围为 。
(4)实验室过滤用到的主要玻璃仪器有 。
(5)阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是 。
(6)操作a包括 和洗涤过程,在洗涤过程中可用 作为洗涤剂。
有甲、乙、丙三种物质: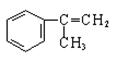
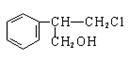

甲乙丙
(1)乙中含有的官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):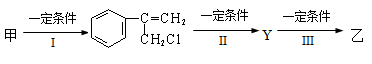
其中反应I的反应类型是_________,反应II的条件是_______________,反应III的化学方程式为__________________________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下: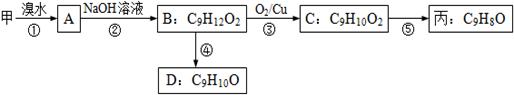
(a)下列物质不能与B反应的是(选填序号)。
a.金属钠b.FeCl3c.碳酸钠溶液d.HBr
(b)丙的结构简式为。
(c)任写一种能同时满足下列条件的D的同分异构体结构简式。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
已知一个碳原子上同时连有两个羟基时,易发生如下转化: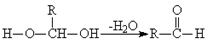
请根据图示回答: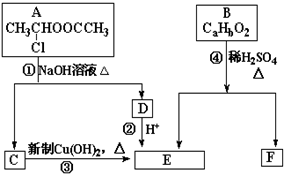
(1)E中含有官能团的名称是_________,③的反应类型是______________,C跟新制的氢氧化铜悬浊液反应的化学方程式为。
(2)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n(H2O) =" 2" :1。F是电脑芯片中高分子光阻剂的主要原料,F具有以下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。则F在一定条件下发生加聚反应的化学方程式为__ ________________________________________________。
(3)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有种结构,写出其中一种同分异构体的结构简式 ______________。
根据下面各物质之间的转化关系,回答问题: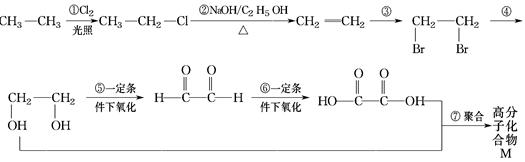
(1)属于取代反应的有(填序号,下同)___________,属于加成反应的有 _________。
(2)写出反应③、④的化学方程式(有机物用结构简式表示,注明反应条件,下同)
a.反应③___________________________________________________________。
b.反应④__________________________________________________________。
(3)写出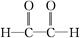 和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式
和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式
___________________________________________________________________。
碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,含氧元素的质量分数为31.58%.A遇FeCl3溶液显紫色,其苯环上的一氯取代物有两种,请回答下列问题:(1)A的分子式是____________________.
(2)若A能与NaHCO3溶液反应,A的结构简式为____________________;写出A与NaHCO3溶液反应的化学方程式__________________________________________________________.
(3)如A可以发生如图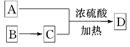 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式为______________________________________________________。
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式为______________________________________________________。
(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度.甲、乙两装置相比较,乙装置有哪些优点________________________.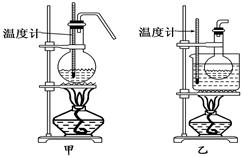
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为;
(2)已知A、B、C有下列转化关系,则反应②的化学方程式为;
C的化学名称为。