我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
| A.均匀分散在水中所形成的分散系属悬浊液 |
| B.分子直径比Na+小 |
| C.均匀分散在水中形成的分散系能产生丁达尔效应 |
| D.“钴酞菁”分子不能透过滤纸 |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是 2Ag+2H+===2Ag++H2 ↑,则下列关于该装置的有关说法正确的是
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属银为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |
在理论上不能用于设计原电池的化学反应是
| A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0 |
B.CH3CH2OH(l)+3O2(g) 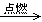 2CO2(g)+3H2O(l) ;△H<0 2CO2(g)+3H2O(l) ;△H<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ;△H<0 |
| D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l) ;△H<0 |
埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是
| A.在潮湿疏松透气的土壤中 | B.在干燥致密不透气的土壤中 |
| C.在含铁元素较多的酸性土壤中 | D.在含碳粒较多,潮湿透气的土壤中 |
对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。下列有关说法中正确的是
| A.电解熔融NaOH可生成金属钠、O2以及H2 |
| B.电解熔融CaCl2时,金属钙在阳极生成 |
| C.可用电解饱和MgCl2溶液的方法获得金属镁 |
| D.电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解 |
下列关于铜电极的叙述正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼精铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阴极 |
| D.电解稀硫酸制H2、O2时铜作阳极 |