下列解释实验事实的化学方程式正确的是
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀: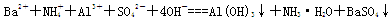 |
| B.KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C.在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
下列粒子中,与NH4+具有相同质子数和电子数的是
| A.OH— | B.F- | C.Na+ | D.NH3 |
在含0.2molKOH和0.1molBa(OH)2混合溶液中持续通入CO26.72L(标况)的过程中,溶液中离子的物质的量n和通入CO2体积V关系示意图正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.45 mL | C.30 mL | D.50 mL |
甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为
| A.2.7g | B.3.6g | C.5.04g | D.4.05g |
标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ = 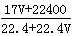 |
B.ω =  |
C.ω =  |
D.c =  |