(1)25℃时,在0.10mol/L的氨水中逐滴加入同浓度的盐酸(不计两者的挥发性),回答下列问题:
①当溶液pH=7时,溶液中c(NH4+) c(Cl-)(用“<”、“>”、“=”填空,下同);
②当盐酸和氨水溶液恰好中和时,溶液中c(H+) c(OH-);
(2)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。某实验小组的同学对该厂生产的印刷电路后所得的废液进行了分析:取50mL废液,向其中加入足量的稀硝酸,生成0.02molNO;另取50mL废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g。
请回答以下问题:
①该厂原来使用的FeCl3溶液中溶质的物质的量浓度为_____(反应前后溶液的体积变化忽略不计);
②废液中各金属阳离子的物质的量浓度之比为C(Fe3+):C(Fe2+):C(Cu2+)=__________;
③另取50mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围是 。
航天技术上使用的氢氧燃料电池具有高能、轻便、不污染环境等优点。氢氧燃料电池有酸式和碱式两种。它们放电时的电池总反应式均可表示为2H2+O2====2H2O。酸式氢氧燃料电池中的电解质是酸,其负极反应可表示为2H2====4H++4e-,则其正极反应可表示为_____________________,碱式氢氧燃料电池中的电解质是碱,其正极反应可表示为O2+2H2O+4e-====4OH-,则其负极反应可表示为______________________________。
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在650 ℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2
 4CO2+4e-
4CO2+4e-
阴极反应式为_____________________,总电池反应为_______________________、还原剂是________________。
(6分)在铜、银和硝酸银构成的原电池工作时,正极为__________________;当有1.6 g铜溶解时,银棒增重__________________。
下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+H2O Zn(OH)2+2Ag____________________________________________。
Zn(OH)2+2Ag____________________________________________。
(2)2C2H2+5O2 4CO2+2H2O__________________________________________________。
4CO2+2H2O__________________________________________________。
(3)6H2O+6CO2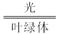 C6H12O6+6O2______________________________________________。
C6H12O6+6O2______________________________________________。
(4)CaCO3 CaO+CO2↑______________________________________________________。
CaO+CO2↑______________________________________________________。
某反应是吸热反应,且所吸收的热能由外部热源(如酒精灯)提供,提供的热能主要起到的作用是
__________________________________________________________________________。