黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为 。
(2)已知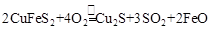 (炉渣),产物Cu2S在1200℃高温下继续反应:
(炉渣),产物Cu2S在1200℃高温下继续反应:
2Cu2S + 3 O2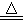 2Cu2O + 2 SO2 ;2Cu2O + Cu2S
2Cu2O + 2 SO2 ;2Cu2O + Cu2S  6Cu + SO2
6Cu + SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量。
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜?
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜?
将一定量由碳、氢、氧三种元素组成的有机化合物A的蒸气与3.2g氧气混合点燃,再将生成的气体依次通过①盛有浓硫酸的洗气瓶②灼热的氧化铜③饱和石灰水(设每个装置中的反应物均过量)。经测定①中增重3.60g②中减重1.60g③中增重8.80g。A蒸气的密度为3.393g/L(已换算成标准状况)。又测知既能与碳酸钠溶液反应又能与金属钠反应,且均有气体生成,但分别得到的气体在相同条件下体积不同。试求该有机物的分子式,并写出其可能的结构简式。
2.22克某元素的氯化物XCl2溶于水形成溶液后,加入40ml 1mol/L AgNO3溶液恰好完全反应。已知该元素原子核内的质子数和中子数相等。
(1)求X元素的质子数和质量数
(2)写出X元素在周期表中的位置
某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,通过计算回答:
(1)推出混合气体中气态烷烃的化学式:
依据题意知混合气体的平均相对分子质量为__ ____,则烷烃一定为。
(2)混合气体中两种气体的物质的量之比:
(3)写出混合气体中气态烯烃可能的结构简式:
一定温度下,在2L密闭容器中充入N2和H2合成NH3,其起始浓度分别为:c(N2)=2mol/L,c (H2 ) =3mol/L,此时压强为5.05×105Pa, 达平衡后测得NH3占总体积的25%。(1)求平衡时的压强;(2)平衡时混合气体对H2的相对密度。
在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g) CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K