把0.6molX气体和0.4molY气体混合2L于容器中使它们发生如下反应:3X(g)+Y(g) 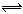 nZ(g)+2W(g),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol·Lˉ1·minˉ1,则上述反应中Z气体的化学化学计量数n是:
nZ(g)+2W(g),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol·Lˉ1·minˉ1,则上述反应中Z气体的化学化学计量数n是:
| A.1 | B.2 | C.3 | D.4 |
下列叙述正确的是
| A.碱性锌锰干电池的负极材料为二氧化锰 |
| B.碱性氢氧燃料电池工作时负极反应为:H2-2e-+2OH-=2H2O |
| C.铅蓄电池放电时负极反应为:PbO2+2e-+4H+=Pb2+++2H2O |
| D.锌一铜一稀硫酸构成的原电池工作时,H+向负极移动 |
一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是
A.2υ(正、A2)= υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
高温下,某反应达平衡,平衡常数 ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
B.恒温恒 容下,增大压强,H2浓度一定减小 容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为 CO + H2O CO2 + H2 CO2 + H2 |
 下列与化学反应能量变化相关的叙述正确的是
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反映的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
D.同温同压下, (g)+ (g)+ (g)="===" 2HCl(g)在光照和点燃条件下的△H不同 (g)="===" 2HCl(g)在光照和点燃条件下的△H不同 |
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法不正确的是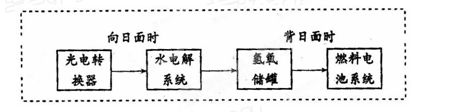
A.该能量转化系统中的水可以 循环利用 循环利用 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-﹣4e-=2H2O+O2↑ |
| D.燃料电池放电时的正极反应:O2 + 4e- + 2H2O=4OH |