为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为: 。
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)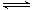 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ;
CH3OCH3(g) + CO2 (g)的ΔH= ;
A、B、C、D、E均为可溶于水的固体,组成它们的离子有:
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- 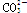 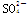 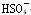 |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是:
A____________;B____________;C____________; D____________;E____________。
有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们分别是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成沉淀或微溶化合物,“—”表示观察不到明显变化。试回答下列问题。
| A |
B |
C |
D |
E |
F |
G |
|
| A |
— |
— |
— |
— |
— |
— |
↓ |
| B |
— |
— |
— |
— |
↓ |
↓ |
↓ |
| C |
— |
— |
— |
↓ |
— |
↓ |
↓ |
| D |
— |
— |
↓ |
— |
↓ |
↓ |
↓ |
| E |
— |
↓ |
— |
↓ |
— |
↓ |
— |
| F |
— |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
| G |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
— |
(1)A的化学式是________,G的化学式是________,判断理由是
___________________________________________________。
(2)写出其余几种物质的化学式:B:________,C:________,D:________,E:________,F:________。
有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。
请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是________________________________________________________________________
________________________________________________________________________。
被检出的物质的化学式(分子式)是________。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
被检出的物质的化学式(分子式)是________。
(3)鉴别余下未检出物质的方法和观察到的现象是
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ |
Ba2+ |
Al3+ |
| 阴离子 |
OH- |
Cl- |
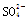 |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:A__________,C__________,D__________,E__________。
(2)A溶液与过量E溶液反应后,最终得到的沉淀的化学式是________。
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: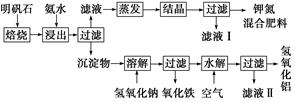
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、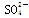 外,还有大量的
外,还有大量的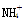 。检验
。检验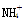 的方法是________________________________________________________________________
的方法是________________________________________________________________________
________________________________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________________________________________。
(4)滤液Ⅰ的成分是水和______________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为__________mol(用含有m、n的代数式表示)。