“绿色化学实验”进课堂,某化学教师为氯气与金属钠反应设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
| A.反应生成的大量白烟是氯化钠晶体 |
| B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 |
| C.钠着火燃烧产生苍白色火焰 |
| D.若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱液完全吸收 |
向2mL 0.5mol· 的
的 溶液中加入3mL 5mol·
溶液中加入3mL 5mol· KF溶液,发现
KF溶液,发现 溶液渐渐褪至无色,再加入KI溶液和
溶液渐渐褪至无色,再加入KI溶液和 振荡后,静置,不见
振荡后,静置,不见 层有紫红色,则下列说法正确的是( )
层有紫红色,则下列说法正确的是( )
A. 不与 不与 发生反应 发生反应 |
B. 与 与 结合成不与 结合成不与 反应的物质 反应的物质 |
C.F-使 的还原性减弱 的还原性减弱 |
D. 被F-还原为 被F-还原为 ,使溶液中不再存在 ,使溶液中不再存在 |
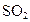 是常见的大气污染物之一,我国规定空气中
是常见的大气污染物之一,我国规定空气中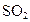 含量不得超过0.02mg/L。下列措施能够减少
含量不得超过0.02mg/L。下列措施能够减少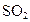 排放量的是( )
排放量的是( )
①用天然气代替煤炭做民用燃料 ②提高热能利用率 ③硫酸厂采用更好的催化剂使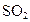 转变成
转变成 ④使用
④使用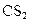 作萃取剂除去煤炭中的硫 ⑤燃烧煤中加入石灰石后使用
作萃取剂除去煤炭中的硫 ⑤燃烧煤中加入石灰石后使用
| A.全部 | B.①②⑤ | C.①③⑤ | D.①③④ |
欲从苯酚的乙醇溶液中回收苯酚,下列操作顺序合理的是( )
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤加入足量的苛性钠溶液
⑥通入过量 气体 ⑦加入足量的三氯化铁溶液 ⑧加入乙酸与浓
气体 ⑦加入足量的三氯化铁溶液 ⑧加入乙酸与浓 混合加热
混合加热
| A.④⑥③ | B.⑧① | C.⑤①⑥③ | D.⑧②⑥③ |
2001年初,用新燃料作能源的“绿色汽车”已驶入我国部分城市,这种汽车可避免有毒的有机铅、苯的同系物以及稠环芳烃的排放,保护环境,这种“绿色汽车”的燃料是( )
| A.甲醇 | B.煤油 | C.重油 | D.汽油 |
将已污染的空气通入某溶液中,测其导电性的变化,能获得某种污染性气体的含量。如把含H2S的空气通入CuSO4溶液中,导电性稍有变化,但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是( )
| A.NaOH溶液 |
| B.蒸馏水 |
| C.Na2SO3溶液 |
| D.KI溶液 |