菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中正确的是
| A.在该反应中维生素C作催化剂 |
| B.因为河虾中含有砷元素,所以不能食用 |
| C.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷可能是+3价砷 |
| D.上述反应中维生素C作氧化剂 |
化学概念是对化学现象与事实的总结和概括。下列说法中正确的是
| A.分散系只包括溶液和胶体 |
| B.使空气中游离态的氮转化为含氮化合物叫做氮的固定,氨的合成即为固氮。 |
| C.单位物质的量的物质所具有的质量叫摩尔质量,摩尔质量与1 mol物质的质量完全相同 |
| D.物质失电子的反应为还原反应 |
如图是进行气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是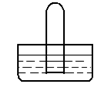
| A.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升,试管中黄绿色褪去 |
| B.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管 |
| C.若水槽中是水(并滴有一定量酚酞),试管中是NH3,可看到液面上升并呈红色 |
| D.若水槽中和试管中都是氯水,光照后可在试管中收集到氧气 |
下列叙述正确的是
| A.SO2具有还原性,故可作漂白剂 |
| B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C.HClO见光会分解,故氯水保存在棕色试剂瓶中 |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
能正确表示下列化学反应的离子方程式的是
| A.氢氧化钡溶液与硫酸的反应 OH-+H+= H2O |
| B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+= Ca2+ + 2H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+= Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
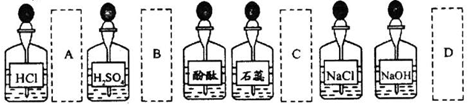
实验室中的药品常按物质的性质、类别等有规律的摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是