下列关于科学家及其提出学说与贡献的叙述不对应的是
| A.道尔顿提出原子学说 |
| B.汤姆生发现电子,并提出原子结构轨道模型 |
| C.舍勒发现了氯气 |
| D.卢瑟福根据α粒子散射现象,提出了带核的原子结构模型 |
下列分子或离子在指定的分散系中能大量共存的一组是
| A.碱性溶液中:ClO-、Cl-、K+、Na+ |
| B.常温常压下气体:O2、N2、Cl2、NH3 |
| C.含有AlO2-的溶液:NO3-、HCO3-、Na+、K+ |
| D.氢氧化铁胶体:H+、K+、S2-、Br- |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目小于0.1 NA |
| B.30g甲醛中含电子对数为4NA |
| C.12 g石墨烯(单层石墨)中含有六元环的个数是0.5NA |
| D.室温下,7.1 g氯气与足量石灰乳充分反应转移电子数小于0.1 NA |
化学与科技、社会、生产、生活密切相关。下列有关说法不正确的是
| A.物质燃烧时产生有色火焰的都是焰色反应的见证 |
| B.棉花、木材和植物秸秆的主要成分都是纤维素 |
| C.航天服主要成分由碳化硅陶瓷和碳纤维复合而成,是一种复合材料 |
| D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
下列叙述和推论都正确的是叙述
| 叙述 |
推论 |
|
| A |
酸性:HCl>H2CO3>H2SiO3 |
非金属性:Cl>C>Si |
| B |
组成原电池时,通常是还原性较强的物质做负极 |
镁和铝在氢氧化钠溶液中组成原电池时,镁做负极 |
| C |
—OH是亲水基,含有—OH的有机物都易溶于水 |
常温时,C2H5OH和 都易溶于水 都易溶于水 |
| D |
溶解度小的沉淀可转化成溶解度更小的沉淀 |
向AgCl的悬浊液中滴加KI溶液可以得到AgI沉淀 |
常温下,向100 mL 0.0l mol.L-lHCl的溶液p 中逐滴加入0. 02 mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是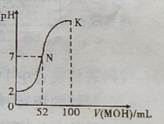
| A.MOH为一元强碱 |
| B.N点水的电离程度小于K点水的电离程度 |
| C.在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) |
| D.K点对应的溶液中,有c( MOH) +c( M+)="0.02" mol.L-1 |