下列实验操作正确的是
| A.可用托盘天平和称量纸称取10.2g NaOH |
| B.某实验需要900ml 0.1mol/L的硫酸铜溶液,则配制该溶液需称取22.5g胆矾晶体 |
| C.用10 mL量筒量取5.2 mL硫酸,仰视时实际量得的液体体积大于5.2 mL |
| D.焰色反应实验中,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
| A.1mol/L甲酸溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 |
| D.在相同条件下,HCN溶液的导电性比强酸溶液的 |
I2在KI溶液中存在下列平衡:
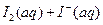

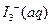
 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,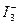 的物质的量浓度c(
的物质的量浓度c(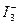 )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )


A.反应 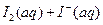  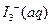 △H>0 △H>0 |
B.若温度为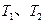 ,反应的平衡常数分别为 ,反应的平衡常数分别为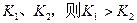  |
C.若反应进行到状态D时,一定有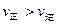  |
D.状态A与状态B相比,状态A的c(I2)大 |
在室温下等体积的酸和碱的溶液,混合后pH一定等于7的是()
| A.pH=3的硝酸和pH=11的Ba(OH)2溶液 | B.pH=3的盐酸和pH=11的氨水 |
| C.pH=3的硫酸和pH=11的KOH | D.pH=3的醋酸和pH=11的KOH溶液 |
2SO2(g)+O2(g) 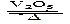 2SO3(g)是制备硫酸的重要反应。下列叙述正确的
2SO3(g)是制备硫酸的重要反应。下列叙述正确的
A.催化剂V2O5不改变该反应的逆反应速率 |
B.增大容器体积,反应速率一定增大  |
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为 |
反应N2O4(g) 2NO2(g);ΔH="+57" kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);ΔH="+57" kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )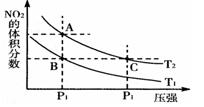
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C