铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,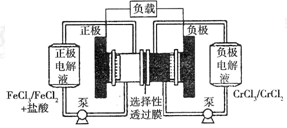
工作原理为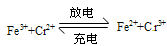 下列说法一定正确的是
下列说法一定正确的是
| A.电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D.电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol·L-1 |
室温时,在指定溶液中能大量共存的一组离子或分子是
| A.使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- |
| B.能使淀粉碘化钾试纸显蓝色的溶液:NH4+、Cu2+、S2-、SO42- |
| C.0.1mol·L-1碱溶液:Al3+、Fe3+、SO42-、Cl2 |
| D.由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3- |
据报道,人工光合作用能够借助太阳能,用CO2和H2O制备HCOOH,其反应原理如下:2CO2+2H2O 2HCOOH+O2,下列说法正确的是
2HCOOH+O2,下列说法正确的是
| A.HCOOH分子中含有极性键,又有非极性键 |
| B.反应中,CO2被氧化,O2是还原产物 |
| C.反应中,每转移4×6.02×1022个电子,生成2.24L气体 |
| D.该过程是将太阳能转化为化学能的过程 |
某废水处理厂处理废水中NH+的过程如下:
①NH4+(aq)+ O2(g)=HNO2(aq)+H+(aq)+H2O(1)ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1)ΔH="-b" KJ/mol
②2HNO2(aq)+O2(g)=2NO3-(aq)+2H+ΔH=-aKJ/mol
下列叙述正确的是( )
| A.将NH4+转化为NO3-的热化学方程式可表示为: NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)ΔH=-(b+  )KJ/mol )KJ/mol |
| B.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
| C.常温下,若HNO3溶液中c(H+)="0.1" mol·L-1,则该溶液的pH>1 |
| D.若上述两次转化完全,不考虑其它杂质离子的存在,则:c(NH4+)+c(OH-)=c(NO3-)+c(H+) |
用下列装置不能达到有关实验目的的是( )
下一代iPhone将在电池方面有所改进,该电池的一极为一种有机高分子的游离基(用R表示)和石墨粉及粘结剂的复合物,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中。有机高分子游离基在空气中十分稳定,在电池充电时被氧化成阳离子,而电池放电时又被还原成游离基。下列有关说法不正确的是( )
| A.放电时,该电池是将化学能转化为电能 |
| B.充电时,R—由阴极向阳极移动 |
| C.放电时,负极发生的反应为Li-e-=Li+ |
| D.充电时,阳极发生的反应为R-xe-=Rx- |