下列说法错误的是(NA表示阿伏伽德罗常数的值)
A.NA个Fe原子的质量为56g,则1个Fe原子的质量为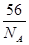 g g |
B.20℃时,铝的密度为2.7g·cm-3,则1个Al原子的体积为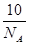 cm3 cm3 |
C.4℃时,水的密度为1.0g·cm-3,则1个H2O分子的体积为 cm3 cm3 |
D.标准状况下,NA个N2分子所占的体积约为22.4L,则1个N2分子的体积为 L L |
向等体积pH均为1的盐酸和醋酸溶液中分别滴加等物质的量浓度的氢氧化钠溶液,当最后得到的两溶液pH相等时,盐酸中用去氢氧化钠溶液的体积为Vl,醋酸中用去氢氧化钠溶液的体积为V2。则Vl和V2的关系正确的是
| A.Vl==V2 | B.Vl>V2 | C.Vl<V2 | D.Vl≤V2 |
下列实验操作中,所使用的有关仪器要求干燥的是
| A.中和滴定实验中所用的锥形瓶 | B.喷泉实验中收集氯化氢气体的圆底烧瓶 |
| C.配制一定物质的量浓度溶液时所用的容量瓶 | D.制取CO时用于收集CO的集气瓶 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为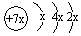 ,b与c形成化合物的电子式
,b与c形成化合物的电子式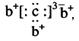 为下列比较中正确的是
为下列比较中正确的是
| A.原子半径:a>c>d>b b | B.原子的氧化性a>b>d>c |
| C.原子序数:a>d>b>c | D.最高价含氧酸的酸性c>d>a |
同温同压下,下列各组热化学方程式中,△H1<△H2是
| A.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
| B.1/2H2(g)+1/2Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 |
| C.2H2(g)+O2(g)=2H2O(g);△H12H2(g)+O2(g)=2H2O(l);△H2 |
| D.C(s)+1/2O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 |
下列叙述不正确的是
| A.原子晶体中原子间平均距离越小,熔、沸点越高 |
| B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体 |
| C.SnH4、GeH4、SiH4、CH4四种物质的熔点依次降低 |
| D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键 |