下表中操作、现象、结论对应关系正确的是
| |
操作 |
现象 |
结论 |
| A |
向某溶液中加入盐酸酸化的BaCl2 |
白色沉淀 |
该溶液中一定有SO42- |
| B |
将SO2气体通入紫色石蕊试液中 |
变红后不褪色 |
SO2的水溶液显酸性 |
| C |
向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
| D |
将过量CO2通入Na2SiO3溶液 |
无沉淀生成 |
CO2最后转化为HCO3- |
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH- 3H2↑+FeO
3H2↑+FeO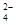 。下列说法正确的是
。下列说法正确的是
| A.铁为阳极,H2SO4为电解液 |
| B.铁为阴极,浓NaOH为电解液 |
C.阳极发生的电极反应为Fe+8OH--6e-===4H2O+FeO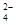 |
| D.铁失去3 mol电子可以在阴极得到33.6 L氢气 |
已知:2CO(g)+O2(g)=2CO2 (g)△H=" -566" kJ.mol-1
Na2O2(s)+CO2(g)=Na2CO3 (s)+ 1/2O2 (g)△H=" -226" kJ.mol-1
根据以上热化学方程式判断,下列说法正确的是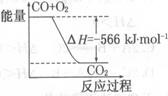
| A.CO的燃烧热为283 kJ |
| B.图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H=" -" 452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2x6.02×l023 |
已知在1×lO5 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
| A.H2O(g)=H2(g)+ 1/2O2 (g)△H="+242" kJ.mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) △H=" -484" kJ.mol-l |
| C.H2(g)+ 1/2O2(g)=H2O(g)△H="+242" kJ.mol-l |
| D.2H2(g) + O2(g) =" 2" H2O(g) △H=" -484" kJ |
下列说法正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.合金都比纯金属易被腐蚀 |
| C.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀 |
| D.钢铁设备上连接铜块可以防止钢铁被腐蚀 |
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作
| A.阴极 | B.阳极 | C.正极 | D.负极 |