(14分)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为零;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________________
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是
(写分子式)_____________________
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: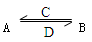
(在水溶液中进行),其中C是溶于水显酸性的气体,D是淡黄色固体。
写出C的结构式_____________;D的电子式____________________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为_______________,由A转化为B的离子方程式____________________________________________________________
②如果A由三种元素组成 ,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因______________________________________________。
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池。工业上在高锰酸钾的催化下,用尿素[CO(NH2)2]与次氯酸钠—氢氧化钠溶液反应制肼。尿素法制肼的反应如下:
CO(NH2)2 +ClO- + 2OH- N2H4 +Cl- + CO32- + H2O,下列说法正确的是
N2H4 +Cl- + CO32- + H2O,下列说法正确的是
| A.CO(NH2)2中N的化合价是-2 | B.CO32-是氧化产物 |
| C.CO(NH2)2分子中既含σ键又含π键 | D.生成2.24L N2H4转移0.2mol电子 |
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 |
| B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) ="l.0" × l0-a,该溶液的pH=7+0.5a |
| D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1AgNO3溶液,先生成Ag2CrO4沉淀 |
下列实验能达到实验目的的是
| 选项 |
实验操作 |
实验目的 |
| A |
室温下,测定等浓度的CH3COOH溶液和盐酸的pH |
比较两种酸的酸性强弱 |
| B |
CH3CH2Br中加入NaOH溶液加热充分反应,取上层水溶液加入AgNO3溶液 |
检验CH3CH2Br中的溴原子 |
| C |
向25ml沸水中滴加4—5滴饱和FeCl3溶液,加热至有红褐色沉淀产生 |
制备Fe(OH)3胶体 |
| D |
在某溶液中先加入HNO3溶液,再加入Ba(NO3)2溶液 |
检验溶液中是否存在SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32- |
| C.无色溶液:Ba 2+、Na+、MnO4-、NO3- |
| D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键。下列说法不正确的是
| A.沸点:W2R>W2Q | B.P与R形成化合物中,阴、阳离子个数比一定为1:2 |
| C.原子半径:W<R<Q<P | D.Q元素形成的酸一定是强酸 |