下列实验方案设计正确的是
| A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B.失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可用碳酸铵溶液鉴别 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.检验从火星上带回来的红色物体是否是Fe2O3 的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于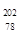 Pt的说法正确的是( )
Pt的说法正确的是( )
A.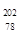 Pt和 Pt和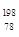 Pt是同一种核素 Pt是同一种核素 |
B.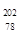 Pt和 Pt和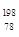 Pt互称为同位素 Pt互称为同位素 |
C.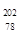 Pt和 Pt和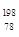 Pt的性质完全相同 Pt的性质完全相同 |
D.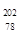 Pt和 Pt和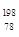 Pt互称为同素异形体 Pt互称为同素异形体 |
下列说法正确的是
| A.铅蓄电池放电时铅电极发生还原反应 |
| B.电解饱和食盐水时在阳极得到氯气,阴极得到金属钠 |
| C.给铁钉镀铜可采用CuSO4作电镀液 |
| D.生铁浸泡在食盐水中发生析氢腐蚀 |
有关下列装置图的说法正确的是()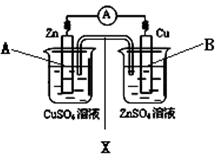
| A.若X是盐桥,则上述装置可以形成原电池 |
| B.若X是铜条,则上述装置不发生任何反应 |
| C.若X是铜条,上述装置中,B电极是阴极 |
| D.若X是铜条,上述装置中,A电极的电极反应式是:Cu2+ + 2e-=Cu |
室温下,下列混合溶液中,各离子浓度的关系正确的是()
| A.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合: 2c(CO32-)+c(OH-)+c(HCO3-)—c(H+)=0.1mol·L-1 |
| B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合 c(SO42-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| C.pH=12的氨水与pH =2的盐酸等体积混合 c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合 |
c(Na+)=c(CH3COO-)>c(OH—)=c(H+)
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是()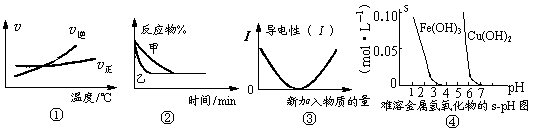
A.根据图①可判断可逆反应“A2(g)+3B2(g)  2AB3(g)”的ΔH>0 2AB3(g)”的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图④,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右 |