某兴趣小组设计如图所示微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。下列有关描述正确的是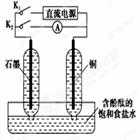
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl- Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-===2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)  2C(g),若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,正确的是()
2C(g),若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,正确的是()
①用物质A表示该反应的平均反应速率为0.3 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
| A.①③ | B.①④ | C.②③ | D.③④ |
下列说法中,可以证明反应N2+ 3H2 2NH3已达到平衡状态的标志是()
2NH3已达到平衡状态的标志是()
A.一个N N键断裂的同时,有三个H—H键形成 N键断裂的同时,有三个H—H键形成 |
B.一个N N键断裂的同时,有三个H—H键断裂 N键断裂的同时,有三个H—H键断裂 |
C.一个N N键断裂的同时,有三个N—H键断裂 N键断裂的同时,有三个N—H键断裂 |
D.一个N N键断裂的同时,有六个N—H键形成 N键断裂的同时,有六个N—H键形成 |
将固体NH4I置于密闭容器中,在某温度下发生如下反应:
NH4I(s)  NH3(g) + HI(g)
NH3(g) + HI(g)
2HI(g)  H2(g) + I2 (g)
H2(g) + I2 (g)
2min后,测得c(H2) =" 0.5" mol·L-1,c(HI) =" 4" mol·L-1,若上述反应速率用v(NH3)表示,下列速率正确的是()
| A.0.5 mol·L-1·min-1 | B.2.5 mol·L-1·min-1 |
| C.2 mol·L-1·min-1 | D.5 mol·L-1·min-1 |
下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是()
| 编号 |
金属 |
酸 |
反应温度 |
|||
| 符号 |
物质的量 |
名称 |
浓度 |
体积 |
||
| A |
Mg |
0.1mol |
硝酸 |
6 mol·L-1 |
10mL |
60℃ |
| B |
Al |
0.1mol |
盐酸 |
3mol·L-1 |
10mL |
60℃ |
| C |
Fe |
0.1mol |
盐酸 |
3mol·L-1 |
10mL |
60℃ |
| D |
Mg |
0.1mol |
硫酸 |
3mol·L-1 |
10mL |
60℃ |
已知反应 A + 3B ="" 2C + D,在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为()
| A.0.5 mol·L-1·min-1 | B.1mol·L-1·min-1 |
| C.2 mol·L-1·min-1 | D.3mol·L-1·min-1 |