下列说法中正确的是
| A.难溶电解质的Ksp越小,溶解度就一定越小 |
| B.一般认为沉淀离子浓度小于1.0×10-5 mol/L时,沉淀就达完全 |
| C.用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
| D.向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是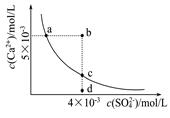
| A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
某学生欲完成反应2HCl+2Ag="=" 2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是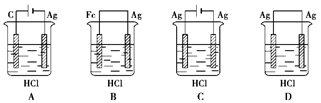
下列说法或表示方法正确的是()
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)===H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
| C.由C(石墨)==C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
D.500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
冰醋酸中加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是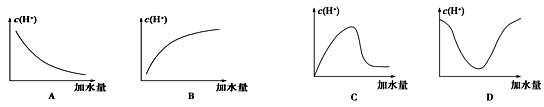
下列关于铜电极的叙述正确的是( )
| A.铜锌原电池中铜是负极 |
| B.用电解法精炼粗铜时,粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜做阳极 |
| D.电解稀硫酸制H2和O2时铜做阳极 |