在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是
A、若平衡时,甲、乙两容器中A的物质的量相等,则x=4
B、平衡时,甲、乙两容器中A、B的物质的量之比不相等
C、平衡时甲中A的体积分数为40%
D、若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
飘尘是物质燃烧时产生的颗粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2、O2接触时会部分转化为SO3,,使空气的酸度增加。飘尘所起的作用是
| A.氧化剂 | B.还原剂 | C.催化剂 | D.净化剂 |
下列试剂或方法不能将硬水软化的是
| A.明矾 | B.磺化酶 | C.加热煮沸法 | D.离子交换法 |
据媒体报道,近年来,我国许多城市实施汽车“油改气”工程,即将燃料由汽油改为液化石油气(含C、H元素),目的是改善城市的空气质量。你认为这项举措可以减少下列哪种气体对空气的污染:①SO2;②CO;③CO2;④NO2
A.①② B.②④ C.①③ D.①④
如图所示,在一熟苹果切片上分别滴上1滴碘水和银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断正确的是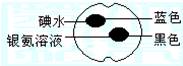
| A.熟透的苹果中含有脂肪 |
| B.熟透的苹果中不含淀粉 |
| C.熟透的苹果中含有还原性的糖 |
| D.熟透的苹果中不含还原性的糖 |
下列食品添加剂与类别对应正确的一组是
| A.着色剂-亚硝酸盐 | B.疏松剂—碳酸氢铵 |
| C.调味剂-苯甲酸钠 | D.防腐剂-醋酸 |