(14分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
①此温度下,该反应的平衡常数K=________(注明单位)。
②保持温度不变,改变CH4和CO2的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内气体平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗2a mol H2
d.混合气中n(CH4)∶n(CO2)∶n(CO)∶n(H2) =1∶1∶4∶4
③已知:a.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
b.CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
c.2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H="__" kJ·mol-1
2CO(g)+2H2(g)的△H="__" kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
CO2+CH4 CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。
CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。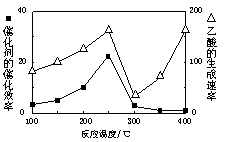
250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是_________。
A.可在碱性氧化物中寻找
B. 可在具有强氧化性的物质中寻找
C.在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式___________ ____________________________________。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,有关电极反应可表示为______________________。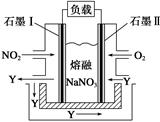
(5分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
② Y原子价电子排布为msnmpn ;
③ R原子核外L层电子数为奇数;
④ Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z在周期表中第族。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于, 1 mol该晶体中含有mol的化学键
A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
(1)写出A、C、E三种元素的名称:
A,C,E。
(2)甲、乙两分子中含有非极性共价键的是(填分子式),它的电子式为。
(3)C、D、F的离子中,半径最小的是(填离子符号)
(4)BA4的空间构型为。
X原子在第二电子层上只有一个空轨道,其轨道表示式为;Y原子的3p轨道上只有一个未成对电子,则Y原子可能是、; Z原子的核电荷数为26,其在元素周期表中的位置是。
选择下列物质填空(填写序号):
①金刚石 ②干冰③氩晶体④白磷⑤氯化钙⑥过氧化钠
⑦石英⑧石墨⑨氯化铵⑩铜晶体
(1)固态时能导电的有
(2)熔化时不破坏化学键的有
(3)含有配位键的有
(4)含有非极性共价键的有
下列说法正确的有。
(1)每一周期元素都是从碱金属开始,以稀有气体结束
(2)f区都是副族元素,s区和p区的都是主族元素
(3)铝的第一电离能大于K的第一电离能
(4)B电负性和Si相近
(5)Ge的电负性为1.8,则其是典型的非金属
(6)半径:K+>Cl—
(7)酸性 HClO>H2SO4,碱性:NaOH > Mg(OH)2
(8)元素的最高正化合价=其最外层电子数=族序数