将1L 0.1 mol•L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5 mol•L-1HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;将500 mL 1 mol•L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出的热量为
| A.(5a-2b) kJ | B.(2b-5a) kJ |
| C.(5a+2b) kJ | D.(10a+4b) kJ |
下列关于有机化合物的说法正确的是
| A.分子式为CH4O和C2H6O的物质一定互为同系物 |
| B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应 |
| C.苯、液溴、溴化铁混合一定条件下可制得溴苯 |
| D.丙烯的结构简式为CH2CHCH3 |
下列关于有机物的说法中,正确的是
| A.可用工业酒精配制饮用酒和调味用的料酒 |
| B.食用白糖的主要成分是蔗糖 |
| C.医用酒精的浓度通常为95% |
| D.液化石油气的主要成分是甲烷 |
化学式为C8H16O2的有机物A在酸性条件下能水解生成C和D,且C在一定条件下能转化为D,则有机物A的结构可能有
| A.1 种 | B.2 种 | C.3 种 | D.4 种 |
若乙醇中的氧为 O,则它与乙酸反应生成的酯的相对分子质量为
O,则它与乙酸反应生成的酯的相对分子质量为
| A.88 | B.90 | C.106 | D.108 |
乙醇分子中不同的化学键如下图所示,对乙醇在各种反应中应断裂的键说明不正确的是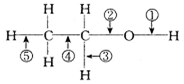
| A.和金属钠作用时,键①断裂 |
| B.和浓H2SO4共热至170℃时,键②和⑤断裂 |
| C.在Ag催化剂下和O2反应时,键①和③断裂 |
| D.和CH2COOH共热时,键②断裂 |