用NA表示阿伏加德罗常数的值.下列说法正确的是
| A.17g羟基中含有的电子数为10NA |
| B.12.0g熔融的NaHSO4中含有的阳离子数为0.2NA |
| C.常温常压下,30g乙酸与30g葡萄糖含有的氧原子数均为NA |
| D.常温下,5.6g Fe投入到足量浓硝酸中,转移电子数为0.3NA |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.遇苯酚显紫色的溶液:Na+、Al3+、Cl-、SCN- |
| B.使甲基橙变红色的溶液:K+、Mg2+、SO42-、NO3- |
| C.加入淀粉碘化钾溶液变蓝色的溶液:Na+、CO32-、HSO3-、OH- |
| D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
下列有关化学用语表示正确的是
A.乙烯的结构简式:CH2CH2
B.硫原子的结构示意图: 
C.基态18 8O的电子排布式:1s22s22p63s23p6
D.过氧化钠的电子式: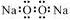
“碧水千河扬长帆,蓝天白云飘纸鸢”我们淮安市人民正在积极建设“碧水蓝天”的生态城市,下列措施中不合理的是
| A.限制化学工业发展,关停所有化工企业,消除污染源头 |
| B.积极推广太阳能、风能等新能源,减少化石燃料的使用 |
| C.加强城市生活污水脱氮除磷处理,遏制水体的富营养化 |
| D.禁止露天焚烧秸杆,推广秸秆沼气、发电、制酒精技术 |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是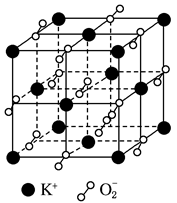
| A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- |
| B.晶体中每个K+周围有8个O2-,每个O周围有8个K+ |
| C.晶体中与每个K+距离最近的K+有8个 |
| D.晶体中,0价氧与-2价氧的数目比为2:1 |