向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是
| A.Cu与Cu2O 的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.酒精可用作燃料,说明酒精燃烧是释放能量的反应 |
| C.干冰气化需要吸收大量的热,这个变化是吸热反应 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |
在恒容的密闭容器中,可逆反应X(s)+3Y(g) 2Z(g);△H>0,达到平衡时,下列说法正确的是
2Z(g);△H>0,达到平衡时,下列说法正确的是
| A.充入少量He使容器内压强增大,平衡向正反应方向移动 |
| B.升高温度,平衡向正反应方向移动,平均分子量变小 |
| C.继续加入少量X,X的转化率减小,Y的转化率增大 |
| D.继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小 |
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g) 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
| A.B的平均消耗速率为0.3mol/(L·min) |
| B.C的平衡浓度为2mol/L |
| C.平衡后,增大压强,平衡将向正方向移动 |
| D.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡 |
下列现象或反应的原理解释正确的是
| 现象或反应 |
原理解释 |
|
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是: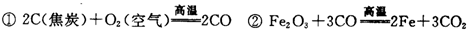
该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是
| A.CO过量 |
| B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 |
| D.CO与氧化铁的反应有一定限度 |