实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,已知Fe3+在pH=5时已完全沉淀,其中分析错误的是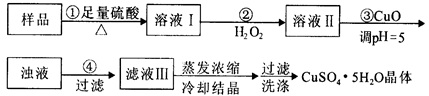
| A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果 |
| B.步骤②中发生的主要反应为:H2O2+2Fe2++2H+=2Fe3++2H2O |
| C.洗涤:向装晶体的漏斗中加水至浸没晶体,待自然流下后重复2~3次 |
| D.某实验需要240 mL1mol/L的CuSO4溶液,则配制时需称量CuSO4·5H2O 60g |
某矿泉水标签上的部分内容为,钙≥4.0mg/L,钾≥0.35mg/L,镁≥0.5mg/L,钠≥0.8mg/L。标签中的钙、钾、镁、钠指的是
| A.原子 | B.单质 | C.元素 | D.分子 |
下列化学用语正确的是
A.HCl的电子式: |
| B.C-12原子: 12C |
| C.乙酸的结构简式:C2H4O2 |
| D.NH3•H2O的电离方程式:NH3•H2O→NH4++OH- |
3He月球上储量丰富,4He则来源于宇宙射线的初级粒子。下列关于3He和4He的说法正确的是
| A.两者互为同位素 | B.两者互为同素异形体 |
| C.两者为同一种原子 | D.两者具有相同的中子数 |
对尼古丁和苯并[a]芘的分子组成与结构描述正确的是()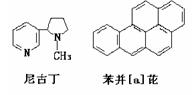
| A.尼古丁的分子式为C10H12N2 |
| B.尼古丁为芳香族化合物 |
| C.苯并[a]芘分子中含有苯环结构单元, 是苯的同系物 |
| D.尼古丁分子中的所有氢原子一定不在同一平面上,苯并[a]芘分子中所有氢原子都在同一平面上 |
某有机物的结构简式如图所示,其名称正确的是
| A.5-乙基-2-己烯 | B.3-甲基庚烯 |
| C.3-甲基-5-庚烯 | D.5-甲基-2-庚烯 |